Plutonium
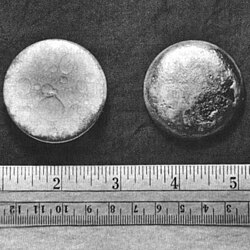
Plutonium adalah sebuah unsur kimia radioaktif dengan lambang Pu dan nomor atom 94. Ia adalah sebuah logam aktinida berwarna abu-abu keperakan yang mengusam saat terkena udara, dan membentuk lapisan kusam saat teroksidasi. Unsur ini pada dasarnya memiliki enam alotrop dan empat keadaan oksidasi. Ia dapat bereaksi dengan karbon, halogen, nitrogen, silikon, dan hidrogen. Ketika terpapar oleh kelembapan udara, ia akan membentuk oksida dan hidrida yang dapat memperluas sampel hingga 70% volume, yang pada gilirannya mengelupas sebagai bubuk yang bersifat piroforik. Ia bersifat radioaktif dan dapat terakumulasi dalam tulang, yang membuat penanganan plutonium menjadi berbahaya, walaupun tingkat toksisitas keseluruhan logam ini terkadang dibesar-besarkan. Plutonium pertama kali diproduksi dan diisolasi secara sintetis pada akhir 1940 dan awal 1941, melalui pemborbardiran sebuah deuteron uranium-238 dalam siklotron 1,5-meter (60 in) di Universitas California, Berkeley. Pertama, neptunium-238 (waktu paruh 2,1 hari) disintesis, yang kemudian mengalami peluruhan beta untuk membentuk unsur baru dengan nomor atom 94 dan berat atom 238 (waktu paruh 88 tahun). Karena uranium dinamai dari planet Uranus dan neptunium dari planet Neptunus, unsur 94 dinamai dari Pluto, yang pada saat itu masih dianggap sebagai sebuah planet. Kerahasiaan masa perang mencegah tim Universitas California menerbitkan penemuannya hingga tahun 1948. Plutonium adalah unsur dengan nomor atom tertinggi yang terjadi di alam. Jumlah jejak plutonium muncul dalam endapan uranium-238 alami ketika uranium-238 menangkap neutron yang dipancarkan oleh peluruhan atom uranium-238 lainnya. Baik plutonium-239 maupun plutonium-241 bersifat fisil, yang berarti bahwa mereka dapat mempertahankan reaksi rantai nuklir, yang mengarah pada aplikasi senjata nuklir dan reaktor nuklir. Plutonium-240 menunjukkan laju fisi spontan yang tinggi, meningkatkan fluks neutron dari setiap sampel yang mengandungnya. Kehadiran plutonium-240 membatasi kegunaan sampel plutonium untuk senjata atau kualitasnya sebagai bahan bakar reaktor, dan persentase plutonium-240 akan menentukan tingkatnya (tingkat senjata, tingkat bahan bakar, atau tingkat reaktor). Plutonium-238 memiliki waktu paruh 87,7 tahun dan memancarkan partikel alfa. Ia adalah sumber panas dalam generator termoelektrik radioisotop, yang digunakan untuk memberi daya pada beberapa wahana antariksa. Isotop plutonium berharga mahal dan tidak mudah untuk dipisahkan, sehingga isotop plutonium tertentu biasanya diproduksi dalam reaktor khusus. Produksi plutonium dalam jumlah yang berguna untuk pertama kalinya merupakan bagian utama dari Proyek Manhattan selama Perang Dunia II yang mengembangkan bom atom pertama. Bomb Fat Man yang digunakan dalam uji coba nuklir Trinity pada Juli 1945, dan pengeboman Nagasaki pada Agustus 1945, memiliki inti plutonium. Eksperimen radiasi manusia yang mempelajari plutonium dilakukan tanpa persetujuan, dan beberapa kecelakaan kritis, beberapa mematikan, terjadi setelah perang. Pembuangan limbah plutonium dari pembangkit listrik tenaga nuklir dan pembongkaran senjata nuklir yang dibangun selama Perang Dingin adalah sebuah bentuk proliferasi nuklir dan kekhawatiran lingkungan. Sumber plutonium di lingkungan lainnya adalah hasil dari berbagai uji coba nuklir di atas tanah, yang sekarang telah dilarang. KarakteristikSifat fisikPlutonium, seperti kebanyakan logam lainnya, pada awalnya berwarna keperakan cerah, seperti nikel, tetapi ia teroksidasi dengan sangat cepat menjadi abu-abu kusam, meskipun kuning dan hijau zaitun juga pernah dilaporkan.[3][4] Pada suhu kamar, plutonium berada dalam fase-α (alfa)-nya. Bentuk ini, bentuk struktur unsur ini (alotrop) yang paling umum, sama keras dan rapuhnya dengan besi tuang kelabu kecuali jika ia dipadukan dengan logam lain untuk membuatnya lunak dan ulet. Berbeda dengan kebanyakan jenis logam, ia bukanlah konduktor panas atau listrik yang baik. Ia memiliki titik lebur yang rendah (640 °C, 1.184 °F) dan titik didih yang sangat tinggi (3.228 °C, 5.842 °F).[3] Ini memberikan kisaran suhu yang besar (lebarnya lebih dari 2.500 K) di mana plutonium berbentuk cair, tetapi kisaran ini bukanlah yang terbesar di antara semua aktinida maupun di antara semua logam.[5] Titik lebur yang rendah serta reaktivitas logam asli dibandingkan dengan oksida menyebabkan oksida plutonium menjadi bentuk yang lebih disukai untuk aplikasi seperti bahan bakar reaktor fisi nuklir (bahan bakar MOX). Peluruhan alfa, pelepasan inti helium berenergi tinggi, adalah bentuk paling umum dari peluruhan plutonium.[6] 239Pu dengan massa 5 kg mengandung sekitar 12,5×1024 atom. Dengan waktu paruh 24.100 tahun, sekitar 11,5×1012 atomnya meluruh setiap detik dengan memancarkan partikel alfa 5,157 MeV. Nilai ini setara dengan 9,68 watt daya. Panas yang dihasilkan oleh perlambatan partikel alfa ini membuatnya hangat saat disentuh.[7][8] Karena waktu paruhnya yang jauh lebih pendek, 238Pu memanas hingga suhu yang jauh lebih tinggi dan bersinar merah panas dengan radiasi benda hitam jika dibiarkan tanpa pemanasan atau pendinginan eksternal. Panas ini telah digunakan dalam generator termoelektrik radioisotop (lihat di bawah). Resistivitas adalah ukuran seberapa kuat suatu material melawan aliran arus listrik. Resistivitas plutonium pada suhu kamar sangatlah tinggi jika dibandingkan dengan logam lain dan ia akan semakin tinggi ketika suhu diturunkan, yang tidak biasa untuk logam.[9] Tren peningkatan resistivitas ini akan diteruskan hingga suhu 100 K. Di bawah suhu ini, resistivitas akan menurun drastis untuk sampel baru.[9] Resistivitas kemudian mulai meningkat kembali dengan waktu sekitar suhu 20 K karena kerusakan radiasi, dengan laju peningkatan ditentukan oleh komposisi isotop sampel.[9] Karena adanya swairadiasi (self-irradiation), sampel plutonium akan mengalami kelelahan (fatigue) pada keseluruhan struktur kristalnya, yang berarti susunan atomnya yang teratur akan dikacaukan oleh radiasi tersebut dari waktu ke waktu.[10] Swairadiasi juga dapat menyebabkan penganilan yang dapat menetralkan beberapa efek kelelahan saat suhu meningkat di atas 100 K.[11] Tidak seperti kebanyakan bahan, kepadatan plutonium meningkat ketika melebur, sebesar 2,5%, tetapi logam plutonium cair menunjukkan penurunan kepadatan linear dengan suhu.[9] Di dekat titik lebur, plutonium cair memiliki viskositas dan tegangan permukaan yang sangat tinggi dibandingkan dengan logam lainnya.[10] Alotrop Plutonium biasanya memiliki enam alotrop dan membentuk alotrop ketujuh (zeta, ζ) pada suhu tinggi dalam kisaran tekanan terbatas.[12] Alotrop-alotrop ini, yang merupakan modifikasi struktural atau bentuk suatu unsur yang berbeda, memiliki energi internal yang sangat mirip tetapi kepadatan dan struktur kristal yang berbeda secara signifikan. Hal ini membuat plutonium sangat sensitif terhadap perubahan suhu, tekanan, atau kimia, dan memungkinkan perubahan volume yang dramatis mengikuti transisi fase dari satu bentuk alotropik ke bentuk lainnya.[10] Kepadatan berbagai alotrop plutonium bervariasi, mulai dari 16,00 g/cm3 hingga 19,86 g/cm3.[13] Keberadaan banyak alotrop ini membuat pemesinan plutonium menjadi sangat sulit, karena ia sangat mudah berubah keadaan. Misalnya, fase-α eksis pada suhu kamar dalam plutonium murni. Ia memiliki karakteristik pemesinan yang mirip dengan besi tuang tetapi berubah menjadi fase-β (beta) plastik dan lunak pada suhu yang sedikit lebih tinggi.[14] Alasan mengapa plutonium memiliki diagram fase yang rumit belumlah sepenuhnya dipahami. Bentuk α memiliki struktur monoklinik dengan simetri rendah, sehingga ia rapuh, kuat, kompresibilitas, dan konduktivitas termal yang buruk.[12] Plutonium dalam fase-δ (delta) umumnya terbentuk pada rentang suhu 310 °C hingga 452 °C, tetapi ia stabil pada suhu kamar saat dipadukan dengan galium, aluminium, atau cerium dalam persentase kecil, meningkatkan kemampuan kerjanya dan memungkinkannya untuk dilas.[14] Bentuk δ memiliki karakter logam yang lebih khas, dan kira-kira sama kuat dan lunaknya dengan aluminium.[12] Dalam senjata fisi, gelombang kejut eksplosif yang digunakan untuk menekan inti plutonium juga akan menyebabkan transisi dari plutonium fase-δ biasa ke fase-α yang lebih padat, yang secara signifikan membantunya mencapai superkritisitas.[butuh rujukan] Fase-ε (epsilon), alotrop padat suhu tertinggi, menunjukkan swadifusi atomik yang sangat tinggi dibandingkan dengan unsur lain.[10] Fisi nuklir Plutonium adalah sebuah logam aktinida radioaktif yang isotopnya, plutonium-239, merupakan salah satu dari tiga isotop fisil utama (sisanya adalah uranium-233 dan uranium-235); plutonium-241 juga bersifat sangat fisil. Agar dapat dianggap fisil, inti atom dari suatu isotop harus dapat memecah (fisi) ketika ditembakkan dengan sebuah neutron yang bergerak lambat dan melepaskan sejumlah neutron tambahan yang cukup untuk mempertahankan reaksi rantai nuklir dengan memecahkan inti selanjutnya.[15] Plutonium-239 murni dapat memiliki faktor penggandaan (keff) lebih besar dari satu, yang berarti bahwa jika logam tersebut tersedia dalam jumlah yang cukup dan dengan geometri yang sesuai (misalnya bola dengan ukuran yang cukup), ia dapat membentuk massa kritis.[16] Selama fisi, sebagian kecil dari energi pengikatan nuklir, yang mengikat inti agar tetap bersama, dilepaskan sebagai energi elektromagnetik dan kinetik dalam jumlah besar (sebagian besar energi kinetik diubah dengan cepat menjadi energi panas). Fisi satu kilogram plutonium-239 dapat menghasilkan ledakan yang setara dengan 21.000 ton TNT (88.000 GJ). Jumlah energi yang sangat besar inilah yang membuat plutonium-239 berguna dalam senjata dan reaktor nuklir.[7] Keberadaan isotop plutonium-240 dalam suatu sampel akan membatasi potensi bom nuklir plutonium, karena plutonium-240 memiliki laju fisi spontan yang relatif tinggi (~440 fisi per detik per gram—lebih dari 1.000 neutron per detik per gram),[17] sehingga meningkatkan tingkat neutron latar, yang pada akhirnya akan meningkatkan risiko pradetonasi.[18] Plutonium dapat dikategorikan ke dalam berbagai tingkatan, yaitu tingkat senjata, tingkat bahan bakar, atau tingkat reaktor, bergantung pada persentase plutonium-240 yang dikandungnya. Plutonium tingkat senjata memiliki kadar plutonium-240 kurang dari 7%. Plutonium tingkat bahan bakar memiliki kadar plutonium-240 dari 7% hingga kurang dari 19%, dan tingkat reaktor daya memiliki kadar plutonium-240 sebesar 19% atau lebih. Plutonium tingkat super, dengan kadar plutonium-240 kurang dari 4%, digunakan dalam senjata Angkatan Laut A.S. yang disimpan di dekat awak kapal dan kapal selam, karena radioaktivitasnya yang lebih rendah.[19] Isotop plutonium-238 tidak bersifat fisil tetapi dapat mengalami fisi nuklir dengan mudah dengan neutron cepat serta dapat mengalami peluruhan alfa.[7] Semua isotop plutonium dapat "dibiakkan" menjadi bahan fisil dengan satu atau lebih absorpsi neutron, baik diikuti peluruhan beta atau tidak. Hal ini membuat isotop plutonium nonfisil menjadi bahan yang subur. Isotop dan nukleosintesis Terdapat setidaknya dua puluh isotop radioaktif plutonium yang telah dikarakterisasi. Isotop yang berumur paling panjang adalah plutonium-244, dengan waktu paruh 80,8 juta tahun, plutonium-242, dengan waktu paruh 373.300 tahun, dan plutonium-239, dengan waktu paruh 24.110 tahun. Semua isotop radioaktif yang tersisa memiliki waktu paruh kurang dari 7.000 tahun. Unsur ini juga memiliki delapan keadaan metastabil, meskipun semuanya memiliki waktu paruh kurang dari satu detik.[6] Plutonium-244 telah ditemukan di ruang antarbintang[20] dan ia memiliki waktu paruh terpanjang dari semua radioisotop nonprimordial. Isotop plutonium yang diketahui memiliki nomor massa yang berkisar mulai dari 228 hingga 247. Mode peluruhan utama isotop dengan nomor massa lebih rendah dari isotop paling stabil, plutonium-244, adalah fisi spontan dan emisi alfa, sebagian besar membentuk isotop uranium (92 proton) dan neptunium (93 proton) sebagai produk peluruhan (dengan mengabaikan berbagai inti anak yang dihasilkan oleh proses fisi). Mode peluruhan utama untuk isotop dengan nomor massa lebih tinggi dari plutonium-244 adalah emisi beta, sebagian besar membentuk isotop amerisium (95 proton) sebagai produk peluruhan. Plutonium-241 merupakan isotop induk dari deret peluruhan neptunium, meluruh menjadi amerisium-241 melalui emisi beta.[6][21] Plutonium-238 dan -239 adalah isotop yang paling sering disintesis.[7] Plutonium-239 disintesis melalui reaksi berikut yang menggunakan uranium (U) dan neutron (n) melalui peluruhan beta (β−) dengan neptunium (Np) sebagai perantara:[22] Neutron yang berasal dari fisi uranium-235 ditangkap oleh inti uranium-238 untuk membentuk uranium-239; sebuah peluruhan beta akan mengubah neutron menjadi proton untuk membentuk neptunium-239 (waktu paruh 2,36 hari) dan peluruhan beta lebih lanjut akan membentuk plutonium-239.[23] Egon Bretscher yang mengerjakan proyek Tube Alloys Britania Raya memprediksikan reaksi ini secara teoretis pada tahun 1940.[24] Plutonium-238 disintesis dengan membombardir uranium-238 dengan deuteron (D, inti hidrogen berat) dalam reaksi berikut:[25] Dalam proses ini, deuteron yang menabrak uranium-238 menghasilkan dua neutron beserta neptunium-238, yang secara spontan meluruh dengan memancarkan partikel beta negatif untuk membentuk plutonium-238.[26] Plutonium-238 juga dapat diproduksi melalui penyinaran neutron dari neptunium-237.[27] Panas peluruhan dan sifat fisiIsotop plutonium mengalami peluruhan radioaktif dan menghasilkan panas peluruhan. Isotop yang berbeda menghasilkan jumlah panas per massa yang berbeda. Panas peluruhan biasanya dinyatakan dengan satuan watt/kilogram, atau miliwatt/gram. Pada potongan plutonium yang lebih besar (misalnya lubang senjata) dan pembuangan panas yang tidak memadai, pemanasan sendiri yang dihasilkan dapat berdampak signifikan.
Sifat kimia dan senyawa Pada suhu kamar, plutonium murni berwarna keperakan tetapi berubah menjadi kusam saat teroksidasi.[29] Unsur ini menunjukkan empat keadaan oksidasi ionik yang umum dalam larutan berair dan satu yang langka:[13]
Warna yang ditunjukkan oleh larutan plutonium bergantung pada keadaan oksidasi dan sifat-sifat anion asam.[31] Anion asamlah yang memengaruhi derajat pengompleksan—bagaimana atom terhubung ke atom pusat—spesies plutonium. Selain itu, keadaan oksidasi plutonium formal +2 diketahui dalam kompleks [K(2.2.2-kriptan)] [PuIICp″3], Cp″ = C5H3(SiMe3)2.[32] Keadaan oksidasi +8 juga dimungkinkan dalam plutonium tetroksida PuO4 yang volatil.[33] Meskipun ia mudah terurai melalui mekanisme reduksi yang mirip dengan FeO4, PuO4 dapat distabilkan dalam larutan basa dan kloroform.[33][34] Logam plutonium diproduksi dengan mereaksikan plutonium(IV) fluorida dengan barium, kalsium atau litium pada suhu 1200 °C.[35] Logam plutonium akan diserang oleh asam, oksigen, dan uap, tetapi tidak oleh alkali dan mudah larut dalam asam klorida, iodida, dan perklorat pekat.[36] Leburan logam plutonium harus disimpan dalam ruang hampa atau atmosfer lengai untuk menghindari terjadinya reaksi dengan udara.[14] Pada suhu 135 °C logam plutonium akan menyala di udara dan akan meledak jika diletakkan dalam karbon tetraklorida.[37]   Plutonium merupakan logam yang reaktif. Di udara lembap atau argon lembap, logam ini akan teroksidasi dengan cepat, menghasilkan campuran oksida dan hidrida.[3] Jika logam ini terpapar cukup lama dengan sejumlah uap air dalam jumlah terbatas, lapisan permukaan PuO2 berbentuk bubuk yang membungkus logam akan terbentuk.[3] Selain itu, juga terbentuk plutonium hidrida. Apabila terpapar dengan uap air yang berlebihan, hanya akan terbentuk PuO2.[36] Plutonium menunjukkan laju reaksi yang sangat besar dan dapat dibalik dengan hidrogen murni, membentuk plutonium hidrida.[10] Ia juga mudah bereaksi dengan oksigen, membentuk PuO dan PuO2 serta oksida intermediat; plutonium oksida mengisi volume 40% lebih banyak daripada logam plutonium. Logam ini bereaksi dengan halogen, menghasilkan senyawa dengan rumus umum PuX3 di mana X dapat berupa F, Cl, Br atau I dan PuF4 juga telah terlihat. Oksihalida berikut telah teramati: PuOCl, PuOBr dan PuOI. Ia akan bereaksi dengan karbon untuk membentuk PuC, nitrogen untuk membentuk PuN dan silikon untuk membentuk PuSi2.[13][37] Kimia organologam kompleks plutonium sangat khas untuk spesies organoaktinida; contoh karakteristik senyawa organoplutonium adalah plutonosena.[23][38] Metode kimia komputasi menunjukkan karakter kovalen yang ditingkatkan dalam ikatan plutonium–ligan.[10][38] Serbuk plutonium, hidridanya, dan oksida tertentunya seperti Pu2O3 bersifat piroforik, artinya mereka dapat menyala secara spontan pada suhu sekitar sehingga harus ditangani dalam atmosfer nitrogen atau argon yang lengai dan kering. Plutonium curah hanya menyala ketika dipanaskan di atas suhu 400 °C. Pu2O3 secara spontan memanas dan berubah menjadi PuO2, yang stabil di udara kering, tetapi bereaksi dengan uap air saat dipanaskan.[39] Krus yang digunakan untuk mengandung plutonium haruslah tahan terhadap lingkungan reduksi yang kuat. Logam tahan api seperti tantalum dan wolfram beserta dengan oksida, borida, karbida, nitrida, dan silisida yang lebih stabil dapat menoleransi lingkungan seperti ini. Peleburan dalam tanur busur listrik dapat digunakan untuk menghasilkan batangan logam kecil tanpa memerlukan krus.[14] Serium digunakan sebagai tiruan kimia plutonium untuk pengembangan penahanan, ekstraksi, dan teknologi lainnya.[40] Struktur elektronikPlutonium adalah sebuah unsur di mana elektron 5f adalah batas transisi antara terdelokalisasi dan terlokalisasi; oleh karena itu, ia dianggap sebagai salah satu unsur yang paling kompleks.[41] Perilaku anomali plutonium disebabkan oleh struktur elektroniknya. Perbedaan energi antara subkulit 6d dan 5f sangatlah rendah. Ukuran kulit 5f cukup untuk memungkinkan elektron membentuk ikatan di dalam kisi, pada batas antara perilaku terlokalisasi dan pengikatan. Kedekatan tingkat energi menyebabkan adanya beberapa konfigurasi elektron berenergi rendah dengan tingkat energi yang hampir sama. Hal ini menyebabkan konfigurasi 5fn7s2 dan 5fn−16d17s2 bersaing, yang menyebabkan kompleksitas perilaku kimianya. Sifat orbital 5f yang sangat terarah bertanggung jawab atas ikatan kovalen terarah dalam molekul dan kompleks plutonium.[10] PaduanPlutonium dapat membentuk paduan dan senyawa intermediat dengan sebagian besar logam lainnya. Pengecualiannya meliputi litium, natrium, kalium, rubidium, dan sesium dari logam alkali; magnesium, kalsium, stronsium, dan barium dari logam alkali tanah; serta europium dan iterbium dari logam tanah jarang.[36] Pengecualian sebagian meliputi logam tahan api kromium, molibdenum, niobium, tantalum, dan wolfram, yang larut dalam plutonium cair, tetapi tidak larut atau hanya sedikit larut dalam plutonium padat.[36] Galium, aluminium, amerisium, skandium dan serium dapat menstabilkan fase-δ plutonium dalam suhu kamar. Silikon, indium, seng, dan zirkonium memungkinkan pembentukan keadaan-δ metastabil ketika didinginkan dengan cepat. Jumlah hafnium, holmium, dan talium yang tinggi juga dapat mempertahankan fase-δ pada suhu kamar. Neptunium adalah satu-satunya unsur yang dapat menstabilkan fase-α pada suhu yang lebih tinggi.[10] Paduan plutonium dapat diproduksi dengan menambahkan sebuah logam ke plutonium cair. Jika logam pemadu cukup reduktif, plutonium dapat ditambahkan dalam bentuk oksida atau halida. Paduan plutonium–galium dan plutonium–aluminium fase-δ diproduksi dengan menambahkan plutonium(III) fluorida pada galium atau aluminium cair, yang memiliki keuntungan untuk menghindari kontak langsung dengan logam plutonium yang sangat reaktif.[42]
Keterjadian Sejumlah kecil isotop plutonium-238, plutonium-239, plutonium-240, dan plutonium-dapat ditemukan di alam. Jumlah plutonium-239 yang lebih kecil lagi, beberapa bagian per triliun, dan produk peluruhannya secara alami ditemukan di beberapa bijih uranium terkonsentrasi,[49] seperti reaktor fisi nuklir alami di Oklo, Gabon.[50] Rasio plutonium-239 terhadap uranium di deposit uranium Tambang Cigar Lake berkisar antara 2,4×10−12 hingga 44×10−12.[51] Jumlah kecil 239Pu ini berasal dari cara berikut: pada kesempatan langka, 238U mengalami fisi spontan, dan dalam prosesnya, ia memancarkan satu atau dua neutron bebas dengan sejumlah energi kinetik. Ketika salah satu neutron ini menumbuk inti atom 238U lainnya, ia diserap oleh atom itu, yang menjadi 239U. Dengan waktu paruh yang relatif singkat, 239U meluruh menjadi 239Np, yang kemudian meluruh menjadi 239Pu.[52][53] Akhirnya, sejumlah kecil plutonium-238, dikaitkan dengan peluruhan beta ganda uranium-238 yang sangat langka, telah ditemukan dalam sampel uranium alami.[54] Karena waktu paruhnya yang relatif panjang, yaitu sekitar 80 juta tahun, diperkirakan bahwa plutonium-244 terjadi secara alami sebagai nuklida primordial, tetapi laporan awal pendeteksiannya tidak dapat dikonfirmasikan.[55] Namun, waktu paruhnya yang panjang memastikan peredarannya melintasi Tata Surya sebelum kepunahannya,[56] dan memang, bukti fisi spontan dari 244Pu yang telah punah telah ditemukan pada beberapa meteorit.[57] Kehadiran 244Pu sebelumnya di Tata Surya awal telah dikonfirmasi, karena ia memanifestasikan dirinya sekarang sebagai surplus dari produk peluruhannya, baik 232Th (dari jalur peluruhan alfa) ataupun isotop xenon (dari fisi spontannya). Yang terakhir umumnya lebih berguna, karena sifat kimia torium dan plutonium agak mirip (keduanya utamanya tetravalen) sehingga surplus torium tidak akan menjadi bukti kuat bahwa beberapa di antaranya terbentuk sebagai produk peluruhan plutonium.[58] 244Pu memiliki waktu paruh terpanjang dari semua nuklida transuranium dan hanya diproduksi dalam proses-r pada supernova dan bintang neutron yang bertabrakan; ketika inti dikeluarkan dari peristiwa ini dengan kecepatan tinggi untuk mencapai Bumi, hanya 244Pu di antara seluruh nuklida transuranium yang memiliki waktu paruh yang cukup lama untuk bertahan dalam perjalanan, sehingga jejak kecil 244Pu antarbintang telah ditemukan di dasar laut dalam. Karena 240Pu juga terjadi dalam rantai peluruhan 244Pu, ia juga harus hadir dalam kesetimbangan sekuler, meskipun dalam jumlah yang lebih kecil.[59] Sejumlah kecil plutonium biasanya ditemukan pada tubuh manusia akibat dari 550 uji coba nuklir di atmosfer dan bawah air serta beberapa kecelakaan nuklir besar yang pernah terjadi.[37] Sebagian besar pengujian nuklir atmosfer dan bawah air dihentikan oleh Traktat Pelarangan Uji Nuklir Sebagian pada tahun 1963, yang mana kekuatan nuklir ditandatangani dan diratifikasi oleh Amerika Serikat, Britania Raya, dan Uni Soviet. Prancis melanjutkan uji coba nuklir atmosfer hingga 1974 dan Tiongkok melanjutkan uji coba nuklir atmosfer hingga 1980. Semua uji coba nuklir selanjutnya dilakukan di bawah tanah.[60] SejarahPenemuanPada tahun 1934, Enrico Fermi dan sekelompok ilmuwan Universitas Roma melaporkan bahwa mereka telah menemukan unsur 94.[61] Fermi menyebut unsur ini sebagai hesperium dan menyebutkannya dalam Kuliah Nobelnya pada tahun 1938.[62] Sampel tersebut sebenarnya mengandung produk fisi nuklir, terutama barium dan kripton.[63] Fisi nuklir, ditemukan di Jerman pada tahun 1938 oleh Otto Hahn dan Fritz Strassmann, belum diketahui pada saat itu.[64]  Plutonium (khususnya, plutonium-238) pertama kali diproduksi, diisolasi dan kemudian diidentifikasi secara kimiawi antara Desember 1940 dan Februari 1941 oleh Glenn T. Seaborg, Edwin McMillan, Emilio Segrè, Joseph W. Kennedy, dan Arthur Wahl melalui pemborbardiran deuteron terhadap uranium dalam siklotron 60-inci (150 cm) di Laboratorium Radiasi Berkeley di Universitas California, Berkeley.[65][66][67] Neptunium-238 diciptakan langsung oleh pemborbardiran itu tetapi meluruh melalui emisi beta dengan waktu paruh lebih dari dua hari, yang menunjukkan pembentukan unsur 94.[37] Pemborbardiran pertama terjadi pada 14 Desember 1940, dan unsur baru itu pertama kali diidentifikasi melalui oksidasi pada malam tanggal 23–24 Februari 1941.[66] Sebuah makalah yang mendokumentasikan penemuan tersebut disiapkan oleh tim dan dikirim ke jurnal Physical Review pada Maret 1941,[37] namun publikasi ditunda hingga setahun setelah berakhirnya Perang Dunia II karena masalah keamanan.[68] Di Laboratorium Cavendish di Cambridge, Egon Bretscher dan Norman Feather menyadari bahwa reaktor neutron lambat berbahan bakar uranium secara teoretis akan menghasilkan sejumlah besar plutonium-239 sebagai produk sampingan. Mereka menghitung bahwa unsur 94 akan bersifat fisil, dan memiliki keuntungan tambahan karena secara kimiawi berbeda dari uranium, dan dapat dengan mudah dipisahkan darinya.[24] Edwin McMillan yang sebelumnya telah menamai unsur transuranium pertama dengan nama neptunium (berasal dari nama planet Neptunus) mengajukan bahwa unsur 94, sebagai unsur transuranium kedua, dinamai dari planet Pluto.[7][note 2] Nicholas Kemmer dari tim Cambridge secara independen mengusulkan nama yang sama, berdasarkan alasan yang sama dengan tim Berkeley.[24] Seaborg pada awalnya mempertimbangkan nama "plutium", namun kemudian merasa bahwa nama tersebut tidak sebagus "plutonium".[70] Dia memilih lambang "Pu" pada awalnya hanyalah sebagai lelucon, mengacu pada kata seru "P U" (Pee-yoo) untuk menunjukkan bau yang sangat menjijikkan, namun ternyata lambang tersebut kemudian tanpa disadari telah terdaftar ke dalam tabel periodik.[note 3] Nama alternatif yang dipertimbangkan oleh Seaborg dan lainnya adalah "ultimium" atau "extremium" karena terdapat kepercayaan bahwa mereka telah menemukan kemungkinan unsur terakhir pada tabel periodik.[72] Hahn dan Strassmann, dan secara terpisah Kurt Starke, pada saat itu juga mengerjakan unsur transuranium di Berlin. Tampaknya Hahn dan Strassmann menyadari bahwa plutonium-239 seharusnya bersifat fisil. Namun, mereka tidak memiliki sumber neutron yang kuat. Unsur 93 dilaporkan oleh Hahn dan Strassmann, serta Starke, pada tahun 1942. Tim Hahn tidak mengejar unsur 94, mungkin karena mereka patah semangat karena McMillan dan Abelson tidak berhasil mengisolasinya ketika mereka pertama kali menemukan unsur 93. Namun, karena tim Hahn memiliki akses ke siklotron yang lebih kuat di Paris pada saat itu, mereka kemungkinan besar dapat mendeteksi plutonium seandainya mereka mencobanya, meskipun dalam jumlah kecil (beberapa becquerel).[73] Penelitian awal Sifat-sifat kimia plutonium ditemukan menyerupai uranium setelah dilakukan kajian awal selama beberapa bulan.[37] Penelitian awal dilanjutkan di Met Lab rahasia Universitas Chicago. Pada tanggal 20 Agustus 1942, sejumlah kecil unsur ini diisolasi dan diukur untuk pertama kalinya. Sekitar 50 mikrogram plutonium-239 yang dikombinasikan dengan uranium dan produk fisi dihasilkan, namun hanya sekitar 1 mikrogram yang berhasil diisolasi.[49][74] Prosedur ini memungkinkan para kimiawan untuk menentukan berat atom unsur baru ini.[75][note 4] Pada tanggal 2 Desember 1942, di lapangan raket di bawah tribun barat di Lapangan Stagg Universitas Chicago, para peneliti yang dipimpin oleh Enrico Fermi mencapai reaksi rantai mandiri pertama dalam tumpukan grafit dan uranium yang dikenal sebagai CP-1. Menggunakan informasi teoretis yang dikumpulkan dari pengoperasian CP-1, DuPont membangun reaktor produksi eksperimental berpendingin udara, yang dikenal sebagai X-10, dan fasilitas pemisahan bahan kimia percontohan di Oak Ridge. Fasilitas pemisahan, menggunakan metode yang dikembangkan oleh Glenn T. Seaborg dan tim peneliti di Met Lab, menghilangkan plutonium dari uranium yang disinari dalam reaktor X-10. Informasi dari CP-1 juga berguna bagi ilmuwan Met Lab yang merancang reaktor produksi plutonium berpendingin air untuk Hanford. Konstruksi di tempat tersebut dimulai pada pertengahan 1943.[76] Pada bulan November 1943, beberapa plutonium trifluorida direduksi untuk membuat sampel logam plutonium pertama: beberapa mikrogram manik-manik logam.[49] Plutonium yang dihasilkan cukup banyak untuk membuatnya menjadi unsur sintetis pertama yang terlihat dengan mata telanjang.[77] Sifat-sifat nuklir plutonium-239 juga dikaji; para peneliti menemukan bahwa ketika dihantam oleh neutron, ia akan memecah (fisi) dengan melepaskan lebih banyak neutron dan energi. Neutron ini kemudian dapat menghantam atom plutonium-239 lainnya, dan mengakibatkan reaksi rantai yang meningkat secara eksponensial. Reaksi rantai ini dapat mengakibatkan ledakan yang cukup besar untuk menghancurkan sebuah kota jika cukup banyak isotop yang terkonsentrasi untuk mencapai massa kritis.[37] Selama tahap awal penelitian, beberapa hewan digunakan untuk mempelajari efek zat radioaktif terhadap kesehatan. Studi ini dimulai pada tahun 1944 di Universitas California di Laboratorium Radiasi Berkeley dan dilakukan oleh Joseph G. Hamilton. Hamilton ingin menjawab pertanyaan mengenai bagaimana plutonium akan bervariasi dalam tubuh tergantung pada mode paparan (ingesti oral, inhalasi, absorpsi melalui kulit), tingkat retensi, dan bagaimana plutonium akan diperbaiki dalam jaringan dan didistribusikan di antara berbagai organ. Hamilton mulai memberikan bagian mikrogram terlarut dari senyawa plutonium-239 kepada tikus menggunakan keadaan valensi yang berbeda dan metode yang berbeda untuk memasukkan plutonium (secara oral, intravena, dll.). Akhirnya, laboratorium di Chicago juga melakukan eksperimen injeksi plutoniumnya sendiri dengan menggunakan berbagai hewan seperti tikus, kelinci, ikan, dan bahkan anjing. Hasil penelitian di Berkeley dan Chicago menunjukkan bahwa perilaku fisiologis plutonium berbeda secara signifikan dengan radium. Hasil yang paling mengkhawatirkan adalah adanya pengendapan plutonium yang signifikan di hati dan di bagian tulang yang "bermetabolisme aktif". Selain itu, laju eliminasi plutonium dalam ekskreta berbeda di antara spesies hewan sebanyak lima kali lipat. Variasi seperti itu membuat sangat sulit untuk memperkirakan berapa lajunya bagi manusia.[78] Produksi semasa Proyek ManhattanSemasa Perang Dunia II, pemerintah AS mencanangkan Proyek Manhattan yang ditugaskan untuk mengembangkan bom atom. Tiga tempat penelitian dan produksi utama dari proyek ini adalah fasilitas produksi plutonium di tempat yang sekarang menjadi Situs Hanford, fasilitas pengayaan uranium di Oak Ridge, Tennessee, dan laboratorium penelitian dan desain senjata yang sekarang ini dikenal sebagai Laboratorium Nasional Los Alamos.[79]   Reaktor produksi pertama yang memproduksi plutonium-239 adalah Reaktor Grafit X-10. Ia mulai bekerja pada tahun 1943 dan dibangun di sebuah fasilitas di Oak Ridge yang kemudian menjadi Laboratorium Nasional Oak Ridge.[37][note 5] Pada bulan Januari 1944, para pekerja meletakkan fondasi untuk gedung pemisahan bahan kimia pertama, Pabrik T yang berlokasi di 200-West. Pabrik T dan fasilitas saudaranya di 200-West, Pabrik U, selesai pada bulan Oktober. (Pabrik U hanya digunakan untuk pelatihan selama Proyek Manhattan.) Gedung pemisahan di 200-East, Pabrik B, selesai pada Februari 1945. Fasilitas kedua yang direncanakan untuk 200-East dibatalkan. Dijuluki Queen Marys oleh para pekerja yang membangunnya, bangunan pemisah itu adalah struktur seperti ngarai yang mengagumkan dengan panjang 800 kaki, lebar 65 kaki, dan tinggi 80 kaki yang berisi empat puluh kolam proses. Interiornya memiliki kualitas yang menakutkan karena operator di balik pelindung beton setinggi tujuh kaki memanipulasi peralatan kendali jarak jauh dengan melihat melalui monitor televisi dan periskop dari galeri atas. Bahkan dengan penutup beton masif pada kolam proses, tindakan pencegahan terhadap paparan radiasi diperlukan dan memengaruhi semua aspek desain pabrik.[76] Pada 5 April 1944, Emilio Segrè yang berada di Los Alamos menerima sampel pertama plutonium yang dihasilkan oleh reaktor dari Oak Ridge.[81] Dalam waktu sepuluh hari, dia menemukan bahwa plutonium yang dihasilkan itu memiliki konsentrasi isotop plutonium-240 yang lebih tinggi daripada plutonium yang dihasilkan dari siklotron. Plutonium-240 memiliki laju fisi spontan yang tinggi dan akan meningkatkan tingkat neutron latar sampel plutonium.[82] Senjata plutonium jenis bedil asli, dengan nama kode "Thin Man", terpaksa dibatalkan karena peningkatan jumlah neutron spontan akan meningkatkan probabilitas terjadinya pradetonasi nuklir.[83] Desain senjata plutonium yang dikerjakan di Los Alamos kemudian diubah menjadi bentuk delakan yang lebih rumit, diberi nama kode "Fat Man". Dengan senjata delakan, plutonium dikompresi hingga kepadatan tinggi dengan lensa ledak—tugas yang secara teknis lebih menakutkan daripada desain jenis bedil sederhana, tetapi perlu menggunakan plutonium untuk keperluan senjata. Sebaliknya, uranium yang diperkaya dapat digunakan dengan kedua metode tersebut.[83] Konstruksi Reaktor B Hanford, reaktor nuklir berskala industri yang pertama untuk keperluan produksi bahan, diselesaikan pada Maret 1945. Reaktor B memroduksi bahan fisil yang digunakan untuk senjata plutonium yang digunakan semasa Perang Dunia II.[note 6] B, D dan F adalah reaktor awal yang dibangun di Hanford, dan enam reaktor penghasil plutonium tambahan dibangun kemudian di lokasi tersebut.[86] Pada akhir Januari 1945, plutonium yang sangat murni menjalani konsentrasi lebih lanjut di gedung isolasi kimia yang telah selesai, di mana pengotor yang tersisa berhasil dihilangkan. Los Alamos menerima plutonium pertamanya dari Hanford pada tanggal 2 Februari. Meskipun masih belum jelas bahwa plutonium yang cukup dapat diproduksi untuk digunakan dalam bom pada akhir perang, Hanford beroperasi pada awal 1945. Hanya dua tahun telah berlalu sejak Kolonel Franklin Matthias pertama kali mendirikan markas sementaranya di tepi Sungai Columbia.[76] Menurut Kate Brown, pabrik produksi plutonium di Hanford dan Mayak di Rusia, selama empat dekade, "keduanya telah melepaskan lebih dari 200 juta curie isotop radioaktif ke lingkungan sekitarnya—dua kali jumlah yang dikeluarkan dalam bencana Chernobyl di setiap kejadian".[87] Sebagian besar kontaminasi radioaktif ini selama bertahun-tahun merupakan bagian dari operasi normal, tetapi kecelakaan tak terduga memang terjadi dan manajemen pabrik merahasiakan hal ini, karena polusi terus berlanjut.[87] Pada tahun 2004, sebuah brankas ditemukan selama penggalian parit pemakaman di situs nuklir Hanford. Di dalam brankas tersebut terdapat berbagai barang, termasuk botol kaca besar berisi bubur keputihan yang kemudian diidentifikasi sebagai sampel plutonium tingkat senjata tertua yang diketahui ada. Analisis isotop yang dilakukan oleh Laboratorium Nasional Pacific Northwest menunjukkan bahwa plutonium dalam botol tersebut diproduksi di Reaktor Grafit X-10 di Oak Ridge pada tahun 1944.[88][89][90] Bom atom Trinity dan Fat Man Uji bom atom pertama, diberi nama kode "Trinity" dan didetonasi pada 16 Juli 1945 dekat Alamogordo, New Mexico, menggunakan plutonium sebagai bahan fisilnya.[49] Desain delakan "gawai", sebagaimana perangkat Trinity diberi nama kode, menggunakan lensa-lensa ledak yang digunakan untuk mengompres bola plutonium agar mencapai massa superkritis, yang secara bersamaan dihujani dengan neutron dari "Urchin", sebuah inisiator yang terbuat dari polonium dan berilium (sumber neutron: reaksi (α, n)).[37] Dengan demikian, ia akan me | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![{\displaystyle {{\mathrm {^{238}_{92}U} }{}+{}{\mathrm {^{1}_{0}n} }{}\mathrel {\longrightarrow } {}{\mathrm {^{239}_{92}U} }{}\mathrel {\xrightarrow {\mathrm {\beta } {\vphantom {A}}^{-}} } {}[23,5\ \mathrm {mnt} ]~{\mathrm {^{239}_{93}Np} }{}\mathrel {\xrightarrow {\mathrm {\beta } {\vphantom {A}}^{-}} } {}[2,3565\ \mathrm {hri} ]~{\mathrm {^{239}_{94}Pu} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4098f26d73ffd83e8cba005e7be94976b62e6741)
![{\displaystyle {\begin{aligned}{{\mathrm {^{238}_{92}U} }{}+{}{\mathrm {^{2}_{1}D} }{}\mathrel {\longrightarrow } {}}&{{\mathrm {^{238}_{93}Np} }{}+{}2{\vphantom {A}}_{\smash[{t}]{0}}^{1}\mathrm {n} }\\&{{\vphantom {A}}_{\hphantom {93}}^{\hphantom {238}}{\mkern {-1.5mu}}{\vphantom {A}}_{{\vphantom {2}}{\llap {\smash[{t}]{93}}}}^{{\smash[{t}]{\vphantom {2}}}{\llap {238}}}\mathrm {Np} {}\mathrel {\xrightarrow {\mathrm {\beta } {\vphantom {A}}^{-}} } {}[2,117\ \mathrm {hri} ]~{\mathrm {^{238}_{94}Pu} }}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/804b7f7e8b0e838418503580ba22e6040b7ab702)