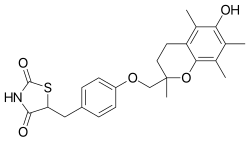
Troglitazon
Troglitazon adalah obat antidiabetes dan antiinflamasi, dan merupakan anggota kelas obat tiazolidindion. Obat ini diresepkan untuk penderita diabetes melitus tipe 2.[1] Obat ini dipatenkan pada tahun 1983 dan disetujui untuk penggunaan medis pada tahun 1997.[2] Obat ini kemudian ditarik. Sejarah Troglitazon dikembangkan oleh Daiichi Sankyo (Jepang). Di Amerika Serikat, obat ini diperkenalkan dan diproduksi oleh Parke-Davis pada akhir tahun 1990-an tetapi ternyata dikaitkan dengan reaksi idiosinkratik yang menyebabkan hepatitis akibat obat. Petugas medis Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) yang ditugaskan untuk mengevaluasi troglitazon, John Gueriguian, tidak merekomendasikan persetujuannya karena potensi toksisitas hati yang tinggi; Parke-Davis mengadu ke FDA, dan Gueriguian kemudian dicopot dari jabatannya.[3] Sebuah panel ahli menyetujuinya pada bulan Januari 1997.[4] Setelah prevalensi efek samping pada hati diketahui, troglitazon ditarik dari pasaran Britania Raya pada bulan Desember 1997, dari pasaran Amerika Serikat pada tahun 2000, dan dari pasaran Jepang segera setelahnya. Obat ini tidak mendapat persetujuan di seluruh Eropa. Troglitazon dikembangkan sebagai obat antidiabetik pertama yang memiliki mekanisme kerja yang melibatkan peningkatan penolakan insulin. Pada saat itu, banyak yang percaya bahwa obat tersebut, dengan mengatasi cacat metabolik utama yang terkait dengan diabetes melitus tipe 2, akan memiliki banyak manfaat termasuk menghindari risiko hipoglikemia yang terkait dengan insulin dan obat antidiabetes oral sebelumnya. Lebih jauh lagi, diyakini bahwa mengurangi resistensi insulin berpotensi mengurangi tingkat penyakit kardiovaskular yang sangat tinggi yang terkait dengan diabetes melitus.[5][6] Parke-Davis/Warner Lambert mengajukan obat diabetes Rezulin untuk ditinjau FDA pada tanggal 31 Juli 1996. Petugas medis yang ditugaskan untuk meninjau, Dr. John L. Gueriguian, mengutip potensi Rezulin untuk membahayakan hati dan jantung, dan ia mempertanyakan kelayakannya dalam menurunkan gula darah untuk pasien dengan diabetes yang dimulai pada usia dewasa, dan merekomendasikan untuk tidak menyetujui obat tersebut. Setelah adanya keluhan dari pembuat obat tersebut, Gueriguian diberhentikan pada tanggal 4 November 1996, dan tinjauannya dihapus oleh FDA.[7][8] Gueriguian dan perusahaan tersebut mengadakan satu pertemuan di mana Gueriguian menggunakan bahasa yang "tidak pantas"; perusahaan tersebut mengatakan bahwa keberatannya didasarkan pada pernyataan yang tidak pantas yang dibuat oleh Gueriguian.[9] Parke-Davis mengatakan di komite penasihat bahwa risiko toksisitas hati sebanding dengan plasebo dan bahwa data tambahan dari penelitian lain mengonfirmasi hal ini.[10] Menurut Peter Gøtzsche, ketika perusahaan memberikan data tambahan ini seminggu setelah persetujuan, mereka menunjukkan risiko yang jauh lebih besar terhadap toksisitas hati.[11] FDA menyetujui obat ini pada 29 Januari 1997, dan obat ini muncul di apotek pada akhir Maret. Pada saat itu, Dr. Solomon Sobel, seorang direktur di FDA yang mengawasi obat-obatan diabetes, mengatakan dalam sebuah wawancara dengan The New York Times bahwa efek samping troglitazon tampaknya jarang terjadi dan relatif ringan.[12] Glaxo Wellcome menerima persetujuan dari Badan Pengawas Obat-obatan Britania Raya (MCA) untuk memasarkan Romozin pada Juli 1997.[13] Setelah laporan tentang gagal hati mendadak pada pasien yang menerima obat tersebut, Parke-Davis dan FDA menambahkan peringatan pada label obat yang mengharuskan pemantauan bulanan terhadap kadar enzim hati.[14] Glaxo Wellcome menarik troglitazon dari pasar di Britania Raya pada 1 Desember 1997.[7] Glaxo Wellcome telah melisensikan obat tersebut dari [[Daiichi Sankyo|Sankyo Company Jepang dan telah menjualnya di Britania Raya sejak 1 Oktober 1997.[15][16] Pada tanggal 17 Mei 1998, seorang pasien berusia 55 tahun bernama Audrey LaRue Jones meninggal karena gagal hati akut setelah mengonsumsi troglitazon. Yang penting, ia telah dipantau secara ketat oleh dokter di Institut Kesehatan Nasional (NIH) sebagai peserta studi pencegahan diabetes National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK).[17][18] Hal ini mempertanyakan kemanjuran strategi pemantauan tersebut. NIH menanggapi pada tanggal 4 Juni dengan menghentikan troglitazon dari studi tersebut.[8][19] Dr. David J. Graham, seorang epidemiologis FDA yang bertugas mengevaluasi obat tersebut, memperingatkan pada tanggal 26 Maret 1999 tentang bahaya penggunaan obat tersebut dan menyimpulkan bahwa pemantauan pasien tidak efektif dalam melindungi terhadap gagal hati. Ia memperkirakan bahwa obat tersebut dapat dikaitkan dengan lebih dari 430 gagal hati dan bahwa pasien mengalami risiko gagal hati 1.200 kali lebih besar saat mengonsumsi Rezulin.[8][20] Dr. Janet B. McGill, seorang ahli endokrinologi yang telah membantu dalam pengujian klinis awal Rezulin oleh Warner–Lambert, menulis dalam suratnya tertanggal 1 Maret 2000 kepada Senator Edward M. Kennedy (D-Mass.): "Saya yakin bahwa perusahaan... sengaja menghilangkan laporan tentang toksisitas hati dan salah menggambarkan kejadian buruk serius yang dialami oleh pasien dalam studi klinis mereka."[21] Pada tanggal 21 Maret 2000, FDA menarik obat tersebut dari pasaran.[22] Dr. Robert I. Misbin, seorang pejabat medis FDA, menulis dalam suratnya tertanggal 3 Maret 2000 kepada Senator John Ashcroft tentang bukti kuat bahwa Rezulin tidak dapat digunakan dengan aman. Ia kemudian diancam oleh FDA dengan pemecatan.[7][23] Pada saat itu, obat tersebut telah dikaitkan dengan 63 kematian akibat gagal hati dan telah menghasilkan penjualan lebih dari $2,1 miliar untuk Warner-Lambert.[20] Obat tersebut menghabiskan biaya sebesar $1.400 per pasien per tahun pada tahun 1998.[16] Pfizer, yang mengakuisisi Warner-Lambert pada bulan Februari 2000, melaporkan penarikan Rezulin menelan biaya sebesar $136 juta.[24] Mekanisme kerjaTroglitazone, seperti halnya tiazolidindion lainnya (pioglitazon dan rosiglitazon), bekerja dengan mengaktifkan reseptor pengaktif proliferator peroksisom (PPAR). Troglitazon adalah ligan untuk PPARα dan – lebih kuat lagi – PPARγ. Troglitazon juga mengandung gugus α-Tokoferol, yang berpotensi memberinya aktivitas seperti vitamin E selain aktivasi PPAR-nya. Troglitazon juga telah terbukti mengurangi peradangan.[25] Penggunaan troglitazon dikaitkan dengan penurunan faktor nuklir kappa-B (NF-κB) dan peningkatan penghambatnya (IκB). NFκB adalah pengatur transkripsi seluler yang penting untuk respons imun. Mekanisme hepatotoksisitasSejak penarikan pada tahun 2000, mekanisme hepatotoksisitas troglitazon telah dipelajari secara ekstensif menggunakan berbagai metode in vivo,[26] in vitro,[27] dan komputasional.[28] Studi-studi ini menunjukkan bahwa hepatotoksisitas troglitazon merupakan hasil dari kombinasi faktor metabolik dan nonmetabolik.[29] Toksisitas nonmetabolik merupakan fungsi kompleks dari interaksi obat-protein di hati dan sistem bilier. Awalnya, toksisitas metabolik sebagian besar terkait dengan pembentukan metabolit reaktif dari cincin tiazolidindion dan kromana troglitazon. Selain itu, pembentukan metabolit reaktif kuinona dan o-kuinona metida diusulkan terbentuk melalui oksidasi metabolik gugus hidroksil (gugus OH) dari cincin kromana.[26] Analisis kimia kuantum terperinci dari jalur metabolisme troglitazon telah menunjukkan bahwa metabolit reaktif kuinon dihasilkan oleh oksidasi gugus OH, tetapi metabolit reaktif o-kuinona metida dibentuk oleh oksidasi gugus metil (gugus CH3) orto terhadap gugus OH dari cincin kromana.[28] Pemahaman ini baru-baru ini digunakan dalam desain turunan troglitazon baru dengan aktivitas antiproliferatif pada lini sel kanker payudara.[30] Gugatan hukumPada tahun 2009, Pfizer menyelesaikan semua kecuali tiga dari 35.000 tuntutan atas obat diabetesnya yang ditarik, Rezulin, dengan total sekitar $750 juta. Pfizer, yang mengakuisisi saingannya, Wyeth, dengan harga hampir $64 miliar, membayar sekitar $500 juta untuk menyelesaikan kasus-kasus Rezulin yang dikonsolidasikan di pengadilan federal di New York, menurut dokumen pengadilan. Perusahaan tersebut juga membayar sebanyak $250 juta untuk menyelesaikan gugatan di pengadilan negara bagian. Pada tahun 2004, perusahaan tersebut menyisihkan $955 juta untuk mengakhiri kasus-kasus Rezulin.[31] Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||