Ikatan polar molekul anorganikIkatan polar molekul anorganik adalah ikatan yang umumnya disebabkan oleh adanya perbedaan keelektronegatifan pada molekul anorganik. Ikatan polar dapat terjadi pada senyawa yang memiliki ikatan ion (ikatan yang terjadi akibat adanya serah terima pasangan elektron) ataupun ikatan kovalen (ikatan yang terjadi akibat adanya pemakaian bersama pasangan elektron). Selain keelektronegatifan, terdapat beberapa faktor lain yang menyebabkan suatu molekul bersifat polar seperti momen dipol, momen ikatan, momen pasangan elektron bebas, kation, anion, serta konfigurasi elektron. Faktor-faktor tersebut merupakan faktor yang disebabkan karena keberadaan molekul itu sendiri. Selain itu, ternyata keberadaan molekul tetangga dapat menyebabkan timbulnya sifat polar. Hal ini dijelaskan melalui gaya antarmolekul yang terjadi dalam molekul tersebut. Kepolaran yang disebabkan karena keberadaan diri molekulKepolaran senyawa kovalenKeelektronegatifanMenurut Linus Pauling, keelektronegatifan merupakan kemampuan suatu atom untuk menarik elektron-elektron dari atom lain ke dalam dirinya sendiri dalam suatu molekul.[1]  Dalam suatu senyawa, apabila atom-atomnya memiliki perbedaan nilai keelektronegatifan maka akan terbentuk ikatan kovalen polar. Ikatan ini terbentuk karena atom yang lebih elektropositif akan kekurangan rapatan elektron sehingga atom yang elektropositif tersebut akan menghasilkan muatan parsial positif (δ+). Sedangkan atom yang lebih elektronegatif akan menghasilkan muatan parsial negatif (δ- ). Muatan parsial ini akan menyebabkan timbulnya momen ikatan yang mempunyai arah dari muatan parsial positif ke muatan parsial negatif. Momen ikatan ini dapat terjadi karena perbedaan keelektronegatifan di antara dua atom yang berikatan. Sebagai contoh, momen ikatan yang terjadi pada molekul HCl.  Pengaruh momen dipol dalam kepolaran molekul anorganikMomen dipol (µ) merupakan jumlah vektor dari momen ikatan dan momen pasangan elektron bebas dalam suatu molekul.[2] Molekul dikatakan bersifat polar jika memiliki µ > 0 atau µ ≠ 0 dan dikatakan bersifat nonpolar jika memiliki µ = 0 . 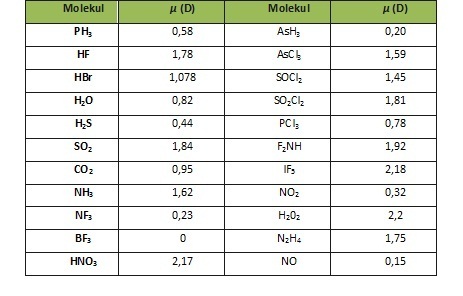


Pengaruh arah momen elektron ikatan dan momen pasangan elektron bebas terhadap kepolaran molekul anorganikMomen pasangan elektron bebas dan momen ikatan yang searah akan memiliki tingkat kepolaran yang lebih tinggi dibandingkan dengan yang berlawanan arah . Contohnya, NH3 dan PCl3 sama-sama bersifat polar, namun tingkat kepolarannya berbeda. Pada molekul NH3, momen ikatan N-H dan momen pasangan elektron bebas memiliki arah yang searah, sedangkan pada molekul PCl3 memiliki momen ikatan dan momen pasangan elektron bebas yang berlawanan arah, sehingga kepolaran NH3 lebih tinggi daripada PCl3. 
Kepolaran senyawa ionPada umumnya, senyawa yang terbentuk akibat penggabungan antara logam dengan nonlogam memiliki sifat senyawa ionik. Akan tetapi, tidak semua senyawa dari penggabungan ini bersifat ionik. Senyawa ini dapat lebih mengarah ke sifat kovalen ketika elektron terluar dari anion ditarik kuat oleh kation, sehingga rapatan anion akan mengalami distorsi/penyimpangan terhadap kation.[3] Distorsi ini dapat dilihat dari rapatan elektron yang mulanya digambarkan seperti bola akan menjadi lonjong (elektron terluar dari anion ditarik kuat oleh kation). Akibat dari distorsi ini maka senyawa yang mulanya bersifat ionik akan berubah menjadi kovalen dan akan terjadi polarisasi. Semakin besar sifat polarisasinya maka semakin besar pula derajat ikatan kovalensinya. Menurut Kasimir Fajans, ahli kimia, terdapat beberapa aturan perihal polarisasi tersebut, antara lain:
Kepolaran yang disebabkan keberadaan molekul tetangganyaMolekul nonpolar dengan molekul nonpolarSuatu molekul monoatomik yang bersifat nonpolar akan menghasilkan muatan positif dan muatan negatif yang berimpit akibat pergerakan distribusi rata-rata inti atom dan elektron di sekitar inti. Rapatan elekton dari molekul tersebut berupa bola yang simetri.  Keadaan elektron yang selalu bergerak menyebabkan polarisasi rapatan elektron dan penyimpangan dari simetri bola. Sehingga pusat muatan positif dan muatan negatif memisah(berbentuk lonjong) dan molekul tersebut dikatakan memiliki dipol sesaat (temporary dipole)  Jika di dekat molekul yang memiliki dipol sesaat terdapat molekul nonpolar, molekul yang memilki dipol sesaat akan menginduksi (dipol induksi) molekul nonpolar tersebut. Akibat adanya dipol sesaat dan dipol induksian tersebut maka akan terbentuk gaya elektrostatik atau yang disebut gaya London di antara kedua molekul tersebut. 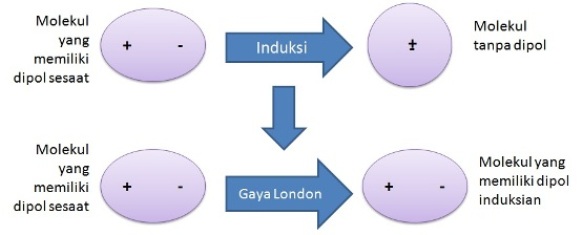 Kemampuan polarisasi atau polarizabilities molekul dinyatakan dengan simbol α. Pada molekul-molekul dengan bentuk yang sama, bertambahnya massa molekul akan menyebabkan bertambahnya jumlah elektron. Hal ini menyebabkan pengaruh inti atom terhadap awan elektron yang semakin lemah, sehingga akan mudah dipolarisasi dan gaya London yang terjadi pun akan semakin kuat. Gaya London yang semakin kuat menyebabkan proses peleburan dan pendidihan molekul-molekul yang terlibat dalam gaya tersebut memerlukan energi yang besar untuk memperbesar jarak antarmolekul nonpolar. 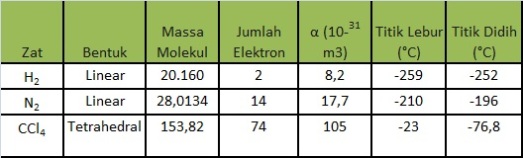
Molekul polar dengan molekul nonpolarMolekul polar yang memiliki dipol permanen akan menginduksi molekul nonpolar yang tidak memiliki dipol, sehingga akan terjadi gaya elektrostatik di antara keduanya atau yang disebut gaya dipol-dipol induksi. Gaya ini menyebabkan senyawa nonpolar dapat larut atau sedikit larut dalam pelarut polar. Misalnya, gaya dipol-dipol induksi antara H2O yang bersifat polar dan O2 yang bersifat nonpolar akan menyebabkan O2 dapat larut sedikt dalam H2O (gas O2 yang dilarutkan dalam 100 gram air memiliki kelarutan 0,006945 pada suhu 0 °C).[4] 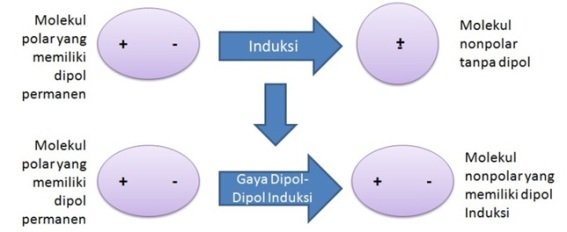 Molekul polar dengan molekul polarKetika molekul yang polar berdekatan dengan molekul yang polar, maka akan timbul gaya elektrostatik di antara keduanya. Gaya ini disebut gaya dipol-dipol. Melalui gaya ini, zat terlarut yang bersifat polar dapat larut dalam pelarut polar yang mempunyai konstanta dielektrik yang besar.  Molekul-molekul polar yang berada dalam fase cair, pusat muatan negatif akan berdekatan dengan pusat muatan positif, begitu pun sebaliknya. Peristiwa ini menyebabkan gaya tarik antar molekul akan lebih kuat daripada gaya tolaknya. 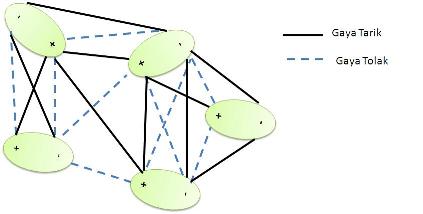
Referensi
Daftar pustaka
Pranala luar
|













